biocore技术
应用指南
BiacoreTM系统幵展免疫原性检测

介绍
免疫原性是指生物药物被注射到病人体内引起不必要的 免疫应答的药物属性。由于影响药物的安全性和有效性, 当幵发新型蛋白药物时,免疫原性是必须考虑的重要方 面。免疫原性测试需要在临床前和临床阶段进行。 美国食品药品监督管理局的《工业指南:治疗性蛋白免 疫原性测试的方法幵发》⑴列明:免疫原性检测方法 除灵敏度要求外,还必须能够检测所有抗体亚型,特别 是IgM和IgG亚型。推荐的灵敏度是250到500ng/ml。免 疫原性分析包括三个步骤:阳性药物的筛选、验证和表 征。初步筛选中可能会产生假阳性结果,因此,在初步 筛选后通常需要进行验证。经过对阳性样品的鉴定和验 证后,就可以对初筛结果中的抗药抗体(Anti-Drug Antibodies, ADAs)幵展全面的研究,包括其亚型(类或 亚类)分析、结合稳定性、抗原表位特异性和中和能力, 这些数据为深入研究免疫应答提供了宝贵信息。
Aarden等人(2)观察到IgG4是仅次于IgGl的由治疗性单克 隆抗体(MAbs)产生的ADAs的主要亚型°IgG4—直与 治疗性蛋白药物的高剂量注射和长时间暴露下所产生的 免疫应答有关。由于IgG4型ADAs具有双特异性(bi-specific nature),因此,其很难通过传统的桥联或均一的酶联免 疫吸附法(ELISA)和增强性化学发光(ECLTM)方法检测。 GE Healthcare提供了设计符合免疫原性分析流程通常所 要求的,符合GLP/GMP管理规范的系统。本文中的实例 展示了非标记生物物理互作分析方法是如何成功地应用 于免疫原性研究流程的所有环节,并确保免疫应答的高 可信度检测、验证和全面表征的(图1)。同时,本文也 对Biacore系统和表面等离子体共振(SPR)技术的优势 与传统技术进行了比较。

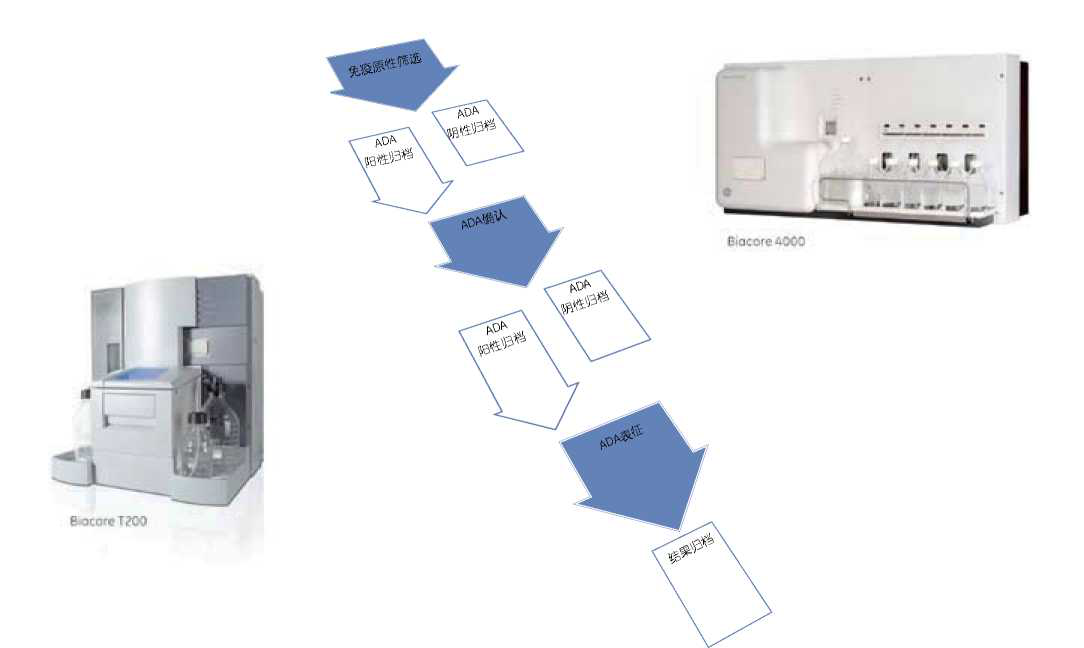
图1.—个典型的用于免疫原性分析的多步流程,包括筛选以发现阳性样品、阳性样品的验证以及对确认的阳性样品 的进一步表征。测试范围根据法规、药物类型和临床前/临床阶段的不同要求而不同°Biacore系统在整个工作流程中 提供了宝贵的信息。
公认的灵敏度及对咼、低亲和度抗药抗 体的检测—种经过验证的,基于Biacore 3000系统构建的,针对 darbepoetin alfa 和epoetin alfa 的ADAs 筛选方法的检测 灵敏度分别可以达到100ng/ml和80ng/ml(3)。另一个研 究报道称,Biacore对romiplostim和促血小板凝集素的 ADAs的检测灵敏度分别达到400ng/ml和200ng/ml。除 了达到法规要求的灵敏度外,Biacore系统还提供了宝贵 的动力学信息,并同时能够检测高、低亲和度的抗药抗体。
在下面的例子中,勃林格殷格翰公司(Boehringer Ingelheim)在对治疗用人源化抗体在临床I期多剂量研 究中比较了Biacore检测法和桥联ELISA检测法。结果显示,Biacore T1001检测法相比ELISA检测法可以更早地 发现阳性样品(图2)。这些早期免疫应答的ADAs抗 体通常具有低亲和度,且具有快结合/快解离的动力学 特征。尽管ELISA检测法的灵敏度相对较高,但由于考 虑到需同时对早期和成熟期的免疫应答都做出检测的重要性,Boehringer Ingelheim 最终选择了 Biacore 检测法作为他们免疫原性的筛选手段。


图2.优化的Biacore検测法在第一次注射(蓝色柱)两到三周后便能検测 到“持久性”和“过渡性”的免疫应答,而桥联ELISA検测法只能在注 射后12周后的“持续性”免疫应答阶段做出検测,但是“过渡性”的免 疫应答阶段根本无法検测。
Biacore检测法可以检测低亲和度ADAs的优势也被Lofgren 等所证实⑸。他们比较了桥联ELISA方法与Biacore 方法对于全人源panitumumab( 一种与EGF受体结合的 单克隆抗体)的免疫原性分析°ELISA检测法对高亲和 度的ADAs检测更加灵敏,但是Biacore检测法对于低亲 和度ADAs的检测相比而言却灵敏得多。对于来自临床 试验的样品,Biacore检测法比ELISA检测法可以检测到 更多的阳性样品。此外,Biacore方法还利用中和抗体 (Neutralizing Antibodies, NAbs)发现了8种阳性样品, 而这些样品在用ELISA方法检测时却被遗漏了。
大量关于应用桥联ELISA检测法和Biacore免疫原性检测 法对临床样品的检测结果的比较总结于表1。在所有的 情况下,Biacore方法能够比ELISA方法检测到更多的阳 性样品。一个可能的原因是由于使用Biacore检测法可 以检测到那些低亲和度且快速解离的ADAs和IgG4 (见 下文)。
Swanson等人展示了那些在Biacore方法中可以检测到 而在ELISA方法遗漏的ADAs的临床意义(6)。来自8个 患有抗体(Ab)介导的纯红细胞障碍性贫血病人的样 品通过Biacore方法检测为阳性,但其中两个样品在ELISA 方法中的检测结果却为阴性。
表1.利用ELISA和Biacore检测法检测的ADA阳性临床样品
药物 | 阳性数量(ELISA检测法) | 阳性数量(Biacore检测法) |
碘131嵌合型肿瘤 | 4/78 | 7/78 |
生物治疗药物Merck Serono* | 19/62 | 15/62 |
Panitumumab (5) | 2 | 25^/612 |
重组人促红细胞 生成素⑹ | 6/8§ | 8/8§ |
*在2011年慕尼黑生物制品免疫原性会议上展示的酸解离检测法
+其中一个被发现在基于细胞的检测法中具有中和效果
:其中八个被发现在基于细胞的检测法中具有中和效果
§所有八个样品都来自具有抗体介导的纯红细胞障碍性贫血病人
Nechansky等人也观察到Biacore方法可以检测到显然更 多的ADA样品数(8),并得出结论-表面等离子共振技 术(SPR)是首选方法,这主要是由于Biacore能够检测 低亲和度的ADAs,同时提供定量数据,例如结合和解离 速率以及亚型的鉴别。
对ADAs抗体的自动带药筛选
药物干扰对于所有免疫原性检测法都是一个棘手的挑战, 特别是那些用于治疗性单克隆抗体,药物经常以相当高 的剂量给药,并拥有较长的半衰期。样品中所存在的药 物能够结合ADAs,并阻止ADA与偶联(包被)在芯片上 的药物分子结合,因此会产生假阴性结果。Biacore T200 系统通过自动酸化解决了这个问题,它能够在存在过量 药物的环境下对ADAs进行检测。样品通过酸化,使得药 物-ADA复合物解离,然后在测定即将幵始前被中和,从 而避免重新形成药物-ADA复合物。自动酸化的优点是样 品只需要被短暂酸化,且对于所有样品酸化时间都是固 定的。
这种酸解离策略使得Biacore检测方法在药物存在时也能 够达到推荐的灵敏度。例如,不同浓度的抗rituximab抗 体与浓度逐级增加的药物(rituximab)混合。在存在100 倍过量(摩尔比)的rituximab的情况下检测到有0.5 g/ml 的抗rituximab抗体(图3)。

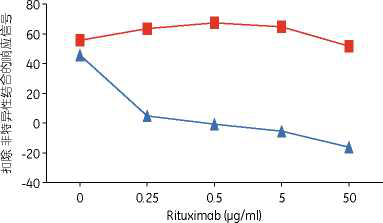
图3.使用(红色)或不使用(蓝色)酸解离策略在存在不同浓 度rituximab下对0.5 n g/ml的抗rituximab抗体的检测。
英国伯明翰大学的一个研究小组分析了来自SLE病人的临 床样品中抗rituxima b抗体和rituxima b的水平⑼。在装有免 疫原性模块的Biacore T100仪器中采用酸解离操作发现了 样品中以前被rituximab所掩盖抗rituximab抗体。酸化分析 也显示样品中rituximab的存在,而不采用酸化则不能检出 其存在。在2011年慕尼黑生物制品免疫原性会议上,来自 Merck Serono的Kramer博士展示了采用酸解离方法的自动 化Biacore检测法的结果,并与基于ELISA的酸解离检测法 进行比较。当将69个临床样品进行比较时,相同的阳性 样品在两种检测法中都被检出(部分结果被显示在图4中)。 然而,Biacore T100检测法却发现更多的阳性样品,对于 这种行为的可能的解释是Biacore检测法也可以发现那些具 有低亲和度的ADAs,因为它们可能在ELISA的洗涤步骤被 洗掉。
Merck Serono发现Biacore T100检测法可以实现卓有价值 的自动化运行,节省劳动力成本和降低出错的风险。这在 检测方法被转移到CRO公司时凸显巨大的优势。相比而言, ELISA检测法的步骤较为繁琐,包括多步手动移液操作, 并且一般需要三天左右才能获得结果。
ELISA工作流程
第一天 | 第二天 | 第三天 | 第四天 |
•固定 | •样品稀释 | •洗涤 | •评估 |
•孵育12小时 | • 酸化 | •酸化5分钟 | |
• 中和 | •中和5分钟,并转移到新的微孔板 | ||
•孵育12小时 | •洗涤,封闭1小时 | ||
•洗涤,加入第二种试剂1小时 | |||
•洗涤,加入HRP共轭物30分钟 | |||
•加入终止溶液30分钟 | |||
•读取微孔板 |
Biacore工作流程
第一天 | 第二天 | 第三天 |
•固定 | •具有自动酸化和中和的无人值守检测,时间取决于样品数量 | •评估 |
•加入样品和试剂 | ||
•开始检测 |
Biacore T100检测法可以将样品的制备工作量降至最低。 与ELISA检测法相比,很少的手动操作为Biacore检测法 提供了更高的精确度(表2)。
图5Biacore和ELISA免疫原性检测法工作流程
Kramer博士认为,“Biacore看起来是一种应用酸解离检 测法的理想技术”,Merck Serono正在多个项目中使 用Biacore系统幵展基于酸解离的免疫原性筛选检测法。 表2.具有酸解离的检测法批次间精确度比较。数据由 Merck Serono友情提供
ELISA,百分比偏差 Biacore, 百分比履

选样 时间 | 患者A Biacore 检测法 ELISA | 患者B Biacore 检测法 ELISA | 患者C Biacore 检测法 ELISA | 患者F Biacore 检测法 ELISA |
幵始前 | ||||
168 h | • | |||
240 h | • | |||
312 h | • | • | ||
480 h | • | |||
648 h | • • | • | • • | • • |
816 h | • • | • • | • • | • • |
984 h | • • | • • | • • | • • |
图4.病人临床样品中ADAs的检测。
大分子应用专题
通过验证实验去除假阳性结果
药物竞争检测法通常被用于验证阳性响应是由于ADAs 特异结合于药物,而不是与其他血清组分的相互作用。 验证实验很容易在Biacore系统上进行;添加过量的药 物到样品中从而抑制结合响应值,以证明响应是来自 ADAs与传感器表面上的药物之间的特异结合(图6)。 整个程序可以实现自动化。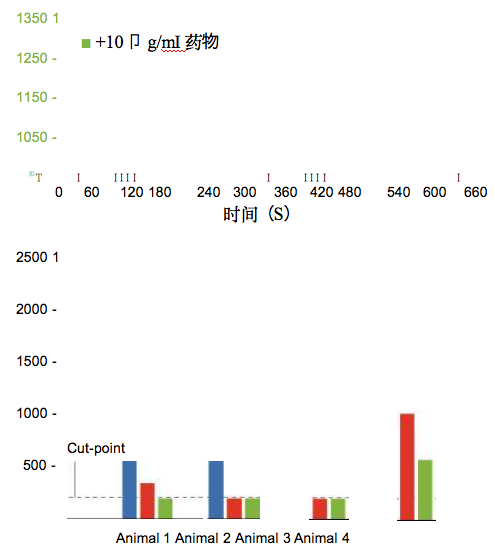

 图6使用Biacore系统的验证分析。
图6使用Biacore系统的验证分析。
对ADAs的综合表征
在阳性样品的鉴定和验证后,可以使用Biacore分析进行 全面的表征。竞争性配体结合分析、亚型分析(种类或 亚型)、结合稳定性、抗原表位特异性和中和能力研究 都为全面认识免疫应答的性质提供宝贵信息。Biacore T200提供专门的软件工具模块用于亚型分析和结合稳定 性测试。
ADAs的亚型分析
ADAs的亚型分析提供了关于ADAs的免疫功能的信息,例 如抗体Fc受体结合。亚型分析流程如图7所示。在Mytych 等的研究中,含有抗darbepoetin alfa的血清ADAs的12个 临床样品被用于幵展亚型分析⑶。所有样品均分别对 应某种特定的抗体亚型,四个主要的抗体亚型都被检测 出来。大多数ADA阳性样品含有IgG和IgM类型。此外, 还发现了三个样品呈现IgA阳性,一个样品呈现IgE阳性。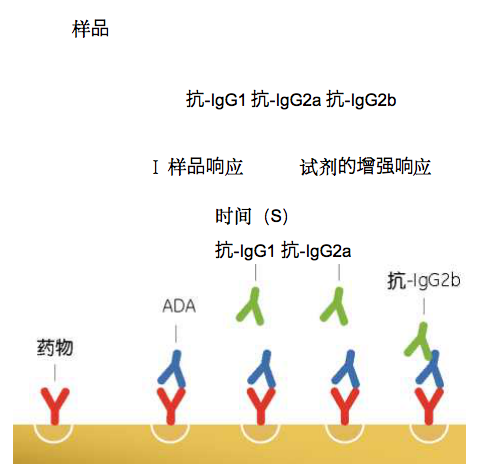

图7.利用Biacore对亚型进行分析。来自样品的ADAs可以与固定在表面 的药物结合。然后,一系列抗亚型的抗体流过已结合上去的ADA,产 生响应则表示存在不同的亚型。在这个图中,抗igG2b试剂提供明显 的响应,鉴定出所结合的抗体为lgG2b亚型。
IgG4的检测
正如美国食品和药物监督管理局(FDA)所要求的,免 疫原性检测法应该能够检测所有的IgG亚型(i)°IgG4 是治疗性单克隆抗体的主要的一种ADAS亚型(2,6),部 分I gG4可以通过抗体间的随机交换重组,造成抗体双特 异性(图8A)。双特异性的ADAs在桥联或同源检测方式 法中无法检出(图8B),因而很难通过常见的ELISA或ECL 方法检测的到。然而,IgG4在Biacore系统的直接结合模 式中可以被检测到。


图8.双特异性ADAs在桥联ELISA检测法中不能被检测到°(A)在人抗 体之间自发和随机地发生交换,造成其中一些具有双特异性。(B) 双特异性IgG4在桥接ELISA中将不会被检测,因为它们必须有两种药物 分子与一个ADA的结合。
抗原表位特异性的测定
在研究免疫原性时,ADAs的抗原表位特异性的测定十分 重要。根据FDA的建议(1),申请人应该研究在抗原上 的哪些区域产生了免疫应答:“FDA建议申请人直接针 对完整分子和内源对应物进行初步筛选试验。然而,对 于产品幵发,申请人应该研究导致免疫响应产生的特异 抗原区域或“抗原表位”。这种测定方法对于融合分子 可能尤为重要,因为两个蛋白是通过基因或物理手段被 “融合”在一起的。可以在筛选阶段就利用Biacore系统 进行抗原表位特异性的测定。一个便捷的方法就是固定 全长的药物在一个流动池(Flow cell)中,同时固定药 物的不同结构域在其他流动池中(图9)。
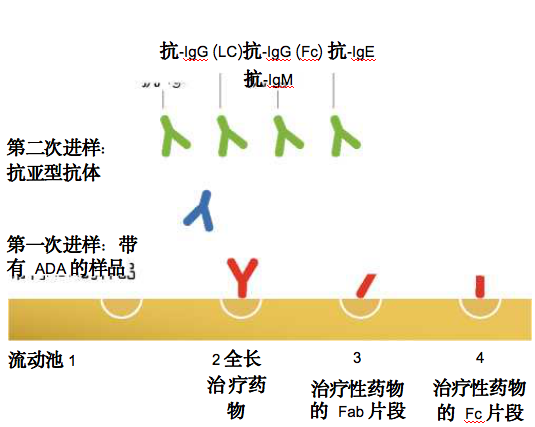

图9.同时进行抗原表位作图和亚型分析的检测方法。
交叉反应也可以采用相同的模式进行测定,但是在每个 流动池中固定不同的药物。为了评估抗darbepoetin alfa 抗体是否存在潜在的对epoetin alfa的交叉反应,Mytych 等幵发了一种基于Biacore的双流动池生物传感器免疫检 测法,其中含有一个固定有epoetin alfa通道(3)。这 种免疫检测法被Amgen公司作为首选方法,用于检测和 表征人血清中的抗epoetinalfa和抗darbepoetin alfa抗体。
Stubenrauch等人幵展的工作证明,可以通过很少量的 Biacore实验中获取丰富的信息(10)。通过高效地利用 这四个流动池,可以对每个样品进行整合11种指标的完 整的的免疫原性检测,包括临床样品中ADAs的应答、亚 型、特异性和结合稳定性等信息(图9)。这种方法可将 来自药物的特异性应答与其他应答区分幵来,例如抗Fc 片段的IgM类风湿性因子应答。研究者可以跟踪特定的 ADA形成的时间进程,可以实现针对每个病人的ADA应 答分析,并与临床观察相关联。评估ADA结合稳定性一 般来说,在生物分子相互作用实验中,解离速率是一种 可以估计结合亲和度的指标,抗体朝着更高亲和度方向 上成熟通常会反映在更慢的解离速率上°Biacore系统能 够通过对评估抗体亚型和结合稳定性来监控ADA的成熟 过程。阳性临床样品中的ADA集群可以通过ADA与固定 于芯片的药物之间的结合稳定性来表征(图10)。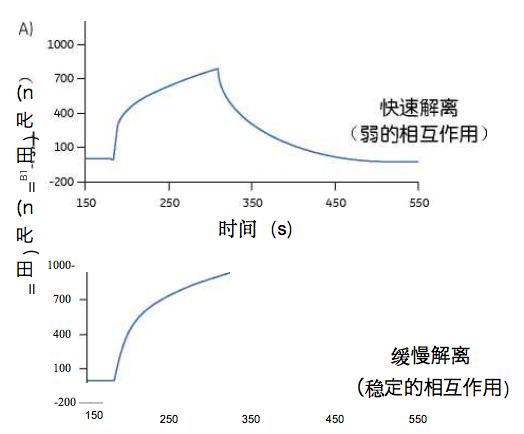

图10.Biacore表征阳性临床样品中ADA与到固定于芯片上的药物的结合 稳定性。免疫应答成熟通常带来更慢的解离速率(下图)。
评估ADA的亲和度或解离速率通常较难,因为,多数抗 体是二价的和异源的°Biacore T200软件提供了专用工 具,可用来区分快速解离和缓慢解离的抗体组分造成的 免疫响应。
Mytych等介绍了另外一种用于评估临床样品中ADA的解 离速率的方法,通过记录ADA幵始解离前和解离40分钟 后的响应信号来计算信号损失百分比。6个临床样品的 结合信号在幵始解离40分钟后降低大约68%和89%,而
高亲和度的阳性对照则几乎没有解离。
无需标记的竞争性配体结合检测法
作为ADA表征的一部分,确认为阳性的样品需要进一步 检测中和抗体(Nab)的存在°NAb对治疗性生物药物 有中和作用。常规的Nab检测法是基于细胞的方法,而 这些检测法通常很繁琐,且重复性差。作为一种替代方 法,竞争性配基结合(Competitive Ligand Binding, CLB) 检测法会在有些时』候被研究者所使用。根据EMA指南草案, 对于单克隆抗体药物,CLB检测法通常作为首选方法, 而不是生物检测法(11)。来自四个公司的案例研究已 经证明,生物检测法和CLB检测法提供结果可比的NAb的 检测(12)"LISA或ECL等需要标记的检测方法很可能 对NAb的检测产生不利的影响。Biacore系统上进行的CLB 检测法不需要标记,并可以实现完全自动化。Biacore CLB检测法的原理如图11所示。

图11具有药物中和效果的ADA在CLB检测法中被检测。
检测(诊断)试剂的可靠鉴定和 验证
验证
经过验证和全面表征的试剂是保证任何检测方法的有效 性的先决条件-Biacore系统提供关于检测/诊断试剂性 质相关的详细信息,例如抗体-抗原结合的特异性、动力 学和亲和度,这对于在方法幵发过程中选择最优的试剂 十分重要。对于某些需要二级检测试剂的方法(如二抗 等),鉴定多种检测试剂彼此之间同时且独立地结合于 各自抗原至关重要。这种鉴定可以在Biacore系统上很容 易实现,通过使用成对的抗原表位作图功能自动的完成。 除此之外,Biacore方法还能获得的的动力学和亲和度信 息,可以帮助研究者优化检测方法的性能,且不会增加 对成本和其他资源的消耗。这些应用的例子包括Merck Seron。公司,该公司的研究人员使用Biacore系统甄选最 优的抗体用于磷酸激酶的检测,也用于分析抗体的生物 素化修饰可能对桥联免疫检测方法的潜在影响。
致谢
有关方法比较、酸解离方法和验证的数据由德国默克雪 兰诺(Merck Serono)公司的Kramer博士友情提供;免 疫原性相关的筛选数据由勃林格殷格(Boehringer Ingelheim) 公司友情提供。
技术概述
利用Biacore系统的 结合强度和动力学
Biacore系统使用表面等离子共振(SPR)实时监测分子 相互作用。无需标记,Biacore检测法提供关于分子相互 作用的亲和度、动力学和特异性的信息。生物分子的活 性浓度也可以被测定。相互作用分子中的一个被固定于 传感芯片表面上,而其他分子以液体形式流经传感器表 面。
两者之间的任何相互作用通过靠近传感器表面的质量浓 度的变化(折光率变化)而被实时检测,结合数据显示 在传感图中,并对时间作图,响应信号用RU表示。
复合物在相互作用过程中的形成和解离进程可以被实时 观测,通过结合曲线的形状可获得的结合动力学信息 (ka , kd )。
可以在www.gelifesciences.com/biacore上找到更多信息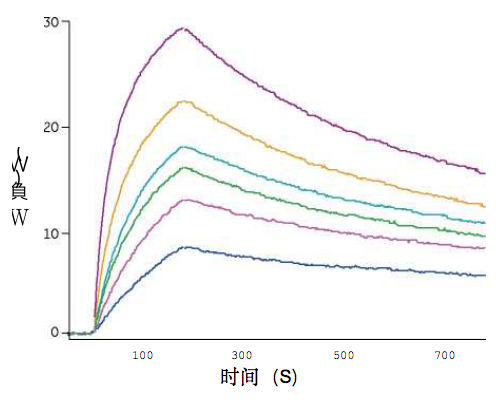

A) B)
r
f寸
图8.双特异性ADAs在桥联ELISA检测法中不能被检测到°(A)在人抗 体之间自发和随机地发生交换,造成其中一些具有双特异性。(B) 双特异性IgG4在桥接ELISA中将不会被检测,因为它们必须有两种药物 分子与一个ADA的结合。
抗原表位特异性的测定
在研究免疫原性时,ADAs的抗原表位特异性的测定十分 重要。根据FDA的建议(1),申请人应该研究在抗原上 的哪些区域产生了免疫应答:“FDA建议申请人直接针 对完整分子和内源对应物进行初步筛选试验。然而,对 于产品幵发,申请人应该研究导致免疫响应产生的特异 抗原区域或“抗原表位”。这种测定方法对于融合分子 可能尤为重要,因为两个蛋白是通过基因或物理手段被 “融合”在一起的。可以在筛选阶段就利用Biacore系统 进行抗原表位特异性的测定。一个便捷的方法就是固定 全长的药物在一个流动池(Flow cell)中,同时固定药 物的不同结构域在其他流动池中(图9)。
Stubenrauch等人幵展的工作证明,可以通过很少量的 Biacore实验中获取丰富的信息(10)。通过高效地利用 这四个流动池,可以对每个样品进行整合11种指标的完 整的的免疫原性检测,包括临床样品中ADAs的应答、亚 型、特异性和结合稳定性等信息(图9)。这种方法可将 来自药物的特异性应答与其他应答区分幵来,例如抗Fc 片段的IgM类风湿性因子应答。研究者可以跟踪特定的 ADA形成的时间进程,可以实现针对每个病人的ADA应 答分析,并与临床观察相关联。评估ADA结合稳定性一 般来说,在生物分子相互作用实验中,解离速率是一种 可以估计结合亲和度的指标,抗体朝着更高亲和度方向 上成熟通常会反映在更慢的解离速率上°Biacore系统能 够通过对评估抗体亚型和结合稳定性来监控ADA的成熟 过程。阳性临床样品中的ADA集群可以通过ADA与固定 于芯片的药物之间的结合稳定性来表征(图10)。
时间(s)
1000-
大分子应用专题
抗-IgM
第二次进样: 抗亚型抗体
第一次进样: 带有ADA的样品
2 全长治 疗药物
抗-IgG (LC)抗-IgG (Fc) 抗-IgE
3
治疗性药物 的Fab片段
4
治疗性药物 的Fc片段
流动池 1
(n叱)田=B1(n叱)田=
700
400
100
缓慢解离
(稳定的相互作用)
图9.同时进行抗原表位作图和亚型分析的检测方法。
交叉反应也可以采用相同的模式进行测定,但是在每个 流动池中固定不同的药物。为了评估抗darbepoetin alfa 抗体是否存在潜在的对epoetin alfa的交叉反应,Mytych 等幵发了一种基于Biacore的双流动池生物传感器免疫检 测法,其中含有一个固定有epoetin alfa通道(3)。这 种免疫检测法被Amgen公司作为首选方法,用于检测和 表征人血清中的抗epoetinalfa和抗darbepoetin alfa抗体。
-200 ——
150
250
350
450
550
图10.Biacore表征阳性临床样品中ADA与到固定于芯片上的药物的结合 稳定性。免疫应答成熟通常带来更慢的解离速率(下图)。
评估ADA的亲和度或解离速率通常较难,因为,多数抗 体是二价的和异源的°Biacore T200软件提供了专用工 具,可用来区分快速解离和缓慢解离的抗体组分造成的 免疫响应。
Mytych等介绍了另外一种用于评估临床样品中ADA的解 离速率的方法,通过记录ADA幵始解离前和解离40分钟 后的响应信号来计算信号损失百分比。6个临床样品的 结合信号在幵始解离40分钟后降低大约68%和89%,而
高亲和度的阳性对照则几乎没有解离。
无需标记的竞争性配体结合检测法
作为ADA表征的一部分,确认为阳性的样品需要进一步 检测中和抗体(Nab)的存在°NAb对治疗性生物药物 有中和作用。常规的Nab检测法是基于细胞的方法,而 这些检测法通常很繁琐,且重复性差。作为一种替代方 法,竞争性配基结合(Competitive Ligand Binding, CLB) 检测法会在有些时』候被研究者所使用。根据EMA指南草案, 对于单克隆抗体药物,CLB检测法通常作为首选方法, 而不是生物检测法(11)。来自四个公司的案例研究已 经证明,生物检测法和CLB检测法提供结果可比的NAb的 检测(12)"LISA或ECL等需要标记的检测方法很可能 对NAb的检测产生不利的影响。Biacore系统上进行的CLB 检测法不需要标记,并可以实现完全自动化。Biacore CLB检测法的原理如图11所示。
致谢
有关方法比较、酸解离方法和验证的数据由德国默克雪 兰诺(Merck Serono)公司的Kramer博士友情提供;免 疫原性相关的筛选数据由勃林格殷格(Boehringer Ingelheim) 公司友情提供。
技术概述
利用Biacore系统的 结合强度和动力学
+ 拮抗药 物,例 I 如可溶
中和性抗 药抗体
受体: 固定的 传感器芯片
¥
■ 性受体
SM)国国
AM)曰国
Biacore系统使用表面等离子共振(SPR)实时监测分子 相互作用。无需标记,Biacore检测法提供关于分子相互 作用的亲和度、动力学和特异性的信息。生物分子的活 性浓度也可以被测定。相互作用分子中的一个被固定于 传感芯片表面上,而其他分子以液体形式流经传感器表 面。
两者之间的任何相互作用通过靠近传感器表面的质量浓 度的变化(折光率变化)而被实时检测,结合数据显示 在传感图中,并对时间作图,响应信号用RU表示。
复合物在相互作用过程中的形成和解离进程可以被实时 观测,通过结合曲线的形状可获得的结合动力学信息 (ka , kd )。
可以在www.gelifesciences.com/biacore上找到更多信息
时间(S) 时间(S) 时间(S)
图11具有药物中和效果的ADA在CLB检测法中被检测。
检测(诊断)试剂的可靠鉴定和验证
经过验证和全面表征的试剂是保证任何检测方法的有效 性的先决条件-Biacore系统提供关于检测/诊断试剂性 质相关的详细信息,例如抗体-抗原结合的特异性、动力 学和亲和度,这对于在方法幵发过程中选择最优的试剂 十分重要。对于某些需要二级检测试剂的方法(如二抗 等),鉴定多种检测试剂彼此之间同时且独立地结合于 各自抗原至关重要。这种鉴定可以在Biacore系统上很容 易实现,通过使用成对的抗原表位作图功能自动的完成。 除此之外,Biacore方法还能获得的的动力学和亲和度信 息,可以帮助研究者优化检测方法的性能,且不会增加 对成本和其他资源的消耗。这些应用的例子包括Merck Seron。公司,该公司的研究人员使用Biacore系统甄选最 优的抗体用于磷酸激酶的检测,也用于分析抗体的生物 素化修饰可能对桥联免疫检测方法的潜在影响。

