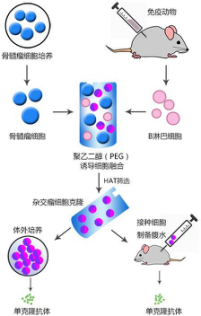
杂交瘤单抗制备流程
单克隆抗体制备服务
利用杂交瘤制备单克隆抗体通常操作流程为:抗原制备、用抗原免疫动物、取免疫动物的脾脏细胞与骨髓瘤细胞融 合成杂交瘤细胞、对杂交瘤细胞进行筛选及克隆化、利用筛选得到的杂交瘤细胞进行单克隆抗体的大量生产。
 抗原制备
抗原制备
用于制备单克隆抗体的抗原纯度越高,单抗制备实验的成功率越高。一般来说,抗原可以是蛋白(天然蛋白或重组蛋白)、多肽、小分子等。
免疫动物
免疫动物的选择
通常,根据所用的骨髓瘤细胞可选用小鼠或大鼠作为免疫动物。因为, 所有的供杂交瘤技术用的小鼠骨髓瘤细胞系均来源于 BALB/c 小鼠,所有的大鼠骨髓瘤细胞都来源于 LOU/c 大鼠,所以一般的杂交瘤生产都是用这两种纯系动物作为免疫动物。就小鼠而言,一般选用 6-8 周龄雌性 Balb/c 小鼠。
制定免疫方案
免疫方案应根据抗原的特性不同而定,选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的 McAb 至关重要。没有一个免疫程序能适用于各种抗原,在设计免疫程序时,应考虑到抗原的性质和纯度、抗原量、免疫途径、 免疫次数与间隔时间、佐剂的应用及动物对该抗原的应答能力等。现用的免疫程序与多克隆抗体制备的方法类似, 免疫途径常用体内免疫法包括皮下注射、腹腔或静脉注射等。
表 1 列举了目前常用的免疫程序:
|
|
| 单抗的特性 | |
抗体滴度 | 亲和性 | |||
免疫源性强(如细胞、细菌或病毒等) | 106-107 个细胞或 1-10ug | 2-4 次,每次间隔 2-4 周 | 高 | 中等至强 |
免疫源性中等 | 10-100ug | 2-4 次,每次间隔 2-4 周 | 中等或高 | 中等或强 |
| 先 2-4 次免疫,每次间隔一个月;然后 2-3 次免疫,每次间隔 2-3 月 |
|
| |
免疫源性弱 | 10-50ug 后200-400ug | 先 2 次剂量 A,每次间隔 1 个月;再4 次剂量 B,每次间隔 1 天 | 中等 | 中等或强 |
| 先 2 次免疫,每次间隔 1 个月;再 4次免疫,每次间隔 10 天;然后“休息”1-2 个月,最后加强 | 中等 | 中等或强 | |
表 1:常见的免疫程序
免疫动物
动物的免疫一般在融合前前两个月,根据确定的免疫方案开始对动物进行初次免疫。动物的免疫通常共有三次,在 初次免疫 2~3 周后进行再次免疫,在再次免疫 3 周后进行加强免疫(如果有需要的话)。一般来说,在最后一次加强免疫后第 3 天取脾进行融合较适宜。由不同抗原产生免疫反应的能力也有强有弱,因此在注射抗原的同时,常常会加入佐剂,以增强抗原的抗原性,刺激机体产生较强的免疫反应。
制备杂交瘤细胞
细胞融合前准备
脾淋巴细胞制备
已经免疫的 BALB/c 小鼠(或 LOU/c 大鼠),在无菌条件下去除脾脏,并完成脾淋巴细胞的制备。
注意:制备脾淋巴细胞过程中,通常也会进行小鼠眼球摘除采血的的操作,将血清分离后作为抗体检测时阳性对照血清。
骨髓瘤细胞制备
骨髓瘤细胞应和免疫动物属于同一品系,这样杂交瘤融合效率高,也便于接种杂交瘤在同一品系小鼠腹腔内产生大量McAB。骨髓瘤细胞的培养可用一般的培养液,如RPMI1640,DMEM 培养基。小牛血清的浓度一般在10%~20%,细胞浓度以 104~105/ml 为宜,最大浓度不得超过 106/ml。当细胞处于对数生长的中期时,可按 1:3~1:10 的比例传代。每 3~5 天传代一次。细胞在传代过程中,部分细胞可能有返祖现象,应定期用 8-氮鸟嘌呤处理,使生存的细胞对 HAT 呈均一的敏感性。
饲养细胞
在组织培养中,单个或少数分散的细胞不易生长繁殖,若加入其它细胞,则可使这些细胞生长繁殖,这种加入的细 胞称为饲养细胞。在细胞融合后选择性培养过程中,由于大量骨髓瘤细胞和脾细胞相继死亡,此时单个或少数分散 的杂交瘤细胞多半不易存活,通常必须加入饲养细胞使之繁殖。常用的饲养细胞有:小鼠腹腔细胞、小鼠脾脏细胞或胸腺细胞。
细胞融合
1) 进行杂交瘤制备的具体操作方法有多种,这里介绍比较常用的一种,读者如果有兴趣可以在网上找其他的操作方法:将骨髓瘤细胞与脾细胞按 1:10 或 1:5 的比例混合在一起,在 50ml 离心管中用无血清不完全培养液洗 1 次, 离心,1200r/min 8 分钟,弃去上清,用吸管吸净残留液体(为了避免影响 PEG 的浓度),轻轻弹击离心管底,使细胞沉淀略松动。
2)用吸管在 60s 内(时间最好控制在 45s 左右)加预热至 40℃的 50% PEG(PH 8.0) 1ml,边加边轻轻搅
拌。
3) 用 10ml 吸管在 90s 内加 20-30ml 预热的不完全培养基(终止 PEG 作用);20-27℃静置 10 分钟。
4) 1000r/min 离心 6 分钟,弃上清
5) 加入 5ml HAT 培养基,轻轻吹吸沉淀细胞,使其悬浮并混匀,然后补加含腹腔巨噬细胞的 HAT 培养基至80-100ml。
6) 分装 96 孔细胞培养板(孔板内有饲养细胞层),每孔 0.1-0.15ml(或分装 24 孔板,每孔 1.0-1.5ml), 然后将培养板置 37℃,6% CO2 培养箱内培养。
7) 5 天后用 HAT 培养基换出 1/2 培养
1. 7-10 天后用 HT 培养基换出 HAT 培养基;
2. 经常观察杂交瘤细胞的生长情况,待其长至孔底面积 1/10 以上时吸出上清供抗体检测。说明:上述步骤中,a~d 为 PEG 介导的细胞融合,e~i 为融合后的 HAT 筛选
融合细胞的筛选
脾细胞和骨髓瘤细胞经 PEG 处理后,形成多种细胞的混合体,只有脾细胞与骨髓细胞形成的杂交瘤细胞才有意义。在 HAT 选择培养液中培养时,由于骨髓瘤细胞缺乏胸苷激酶或次黄嘌呤鸟嘌呤核糖转移酶,故不能生长繁殖,而杂交瘤细胞具有上述两种酶,在 HAT 选择培养液可以生长繁殖。
杂交瘤细胞的克隆化
所谓克隆化是指使单个细胞无性繁殖而获得该细胞团体的整个培养过程。通常在得到针对预定抗原的杂交瘤以后需连续进行 2-3 次克隆化,有时还需进行多次。克隆化的方法很多,如有限稀释法、软琼脂法、单细胞显微操作法、单克隆细胞集团显微操作法和荧光激活细胞分类仪(FACS)分离法。(相关阅读:杂交瘤细胞亚克隆常用方法) 杂交瘤细胞克隆化的意义
从原始孔中得到的阳性杂交瘤细胞,可能来源于二个或多个杂交瘤细胞,因此它们所分泌的抗体是不同质的。为了得到完全同质的单克隆抗体,必须对杂交瘤细胞进行克隆化。另一方面,杂交瘤细胞培养的初期是不稳定的,有的细胞丢失部分染色体,可能丧失产生抗体的能力。为了除去这部分已经不再分泌抗体的细胞,得到分泌抗体稳定的单克隆杂交瘤细胞系,也需要克隆化。另外,长期液氮冻存的杂交瘤细胞,复苏后其分泌抗体的功能仍有可能丢失, 因此也应作克隆化,以检测抗体分泌情况。
杂交瘤细胞的冻存
杂交瘤细胞制备单克隆抗体的过程中,通常将一部分杂交瘤细胞冻存起来备用,便于以后大规模生产单克隆抗体以 及避免外部不可测的影响因素对实验带来过大的影响。
利用杂交瘤细胞大规模生产单抗
利用杂交瘤细胞大量制备单克隆目前主要有两种方法,一种是动物体内生产法,另外一种是体外培养法。
动物体内生产单抗的方法
鉴于绝大多数动物用杂交瘤均由 BALB/c 小鼠(或 LOU/c 大鼠)的骨髓瘤细胞与同品系的脾细胞融合而得,因此使用的动物首选 BALB/c 小鼠(或 LOU/c 大鼠)。将杂交瘤细胞接种于小鼠腹腔内,在小鼠腹腔内生长杂交瘤, 并产生腹水,可得到大量的腹水单抗。该法操作简便、经济且抗体浓度很高。但是,腹水中常混有小鼠的各种杂蛋 白(包括 Ig),因此得到的腹水抗体要提纯后才能使用。
体外培养法
体外培养可以采用单层细胞培养的形式,也可以采用悬浮培养的形式。细胞体外培养一定时间后,收集培养上清液, 离心去除细胞及其碎片,即可获得所需要的单克隆。抗体相较于免疫动物生产单克隆抗体的方法,体外培养不需要对得到的抗体进行纯化,但该法的产量较低且费用昂贵。
抗体的检测
检测抗体的方法有多种,根据抗体类型的不同,可以选择不同的筛选方法,一般以快速、简便、特异、敏感的方法 为优先。其中最常用的为酶联免疫吸附实验(ELISA)法。
ELISA 的原理为:将使抗原(或抗体)结合到某种固相载体表面,使抗体(或抗原)与某种酶连接成酶标抗体(或抗原),将待测抗体与酶标抗体(或抗原)按不同的步骤与固相载体表面的抗原(或抗体)起反应。最终结合在固 相载体的酶标抗体量与待检测抗体的量呈一定比例。加入酶反应底物,底物被酶催化显色,根据颜色的深浅便进行 定性或定量分析。
其它常用的方法有:
放射免疫测定(RIA) 可用于可溶性抗原、细胞 McAb 的检测。免疫荧光试验 适合于细胞表面抗原的 McAb 的检测。
其它检测方法如间接血凝试验、细胞毒性试验、旋转粘附双层吸附试验等。

