
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
LSPR技术
技术指南:COOH传感器与胺偶联试剂盒
1、概述
在COOH传感器芯片表面上具有均匀的的羧基层。这些羧基能够被标准EDC/NHS化学物激活并通过氨基化学偶联配体 (图1)。Nicoya胺基偶联试剂盒中包含所有完成该偶联所需的试剂而且试剂盒已被优化为最佳性能。这种耦联方法使得配体稳定的附着于表面,并且结合的相互作用可以很容易在OpenSPR仪器上测量。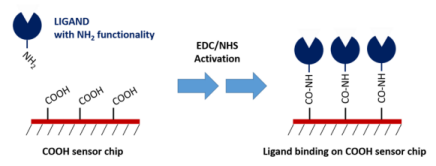
共价偶联
2、实验需要的试剂及仪器
● COOH传感器芯片:储存在2-8°C
● NHS:储存在2-8°C,一旦稀释分装,储存在–20°C
● EDC:储存在2-8°C,一旦稀释分装,储存在–20°C
● 激活缓冲液:储存在2-8°C
● 封闭液:储存在2-8°C
● 运行缓冲液:1X PBS pH 7.4(需要老师配)
● 80%的IPA (异丙醇)(需要老师提供)
● 去离子水(需要老师提供)
● 瞬时离心机(需要老师提供)
● 移液枪及枪头(1ml,200ul,100ul)(需要老师提供)
● 配体(固定到芯片):蛋白纯度高于90%,浓度(30-100ug/ml),体积大于200ul
● 分析物:蛋白或大分子浓度(30-100ug/ml),体积大于200ul,小分子(溶于DMSO的)要求浓度大于100uM 或30mg/ml
● 再生缓冲液100mM的HCL,或1%的SDS
EDC分装准备
1)将EDC溶解于1mL活化缓冲液中
2)用移液器分装成10个100µL,储存在–20°C.
NHS 分装准备
1)将NHS溶解于1mL活化缓冲液中
2)用移液器分装成10个100µL,储存在–20°C.
注:试剂必须从分装瓶里现取现用,且在使用前混合。EDC / NHS酯的半衰期较短,因此配体激活后立刻上样。此外,蛋白质长时间在低pH值下通常不稳定,所以配体稀释到激活缓冲液后要立即注入。
再生缓冲液参考:
1. Acid 5-150 mM | 2. SDS 0.01 – 0.5% |
Proteins | Peptides |
Antibodies | Proteins/Nucleic acids |
3. NaoH 10 mM | 4. IPA:HCl 1:1 |
Nucleic acids/Nucleic acids | ■Lipids |
缓冲条件
通常将大的配体如蛋白质固定在COOH传感器芯片上的方法预富集。预富集是利用静电力在传感器的表面增加配体的局部浓度的技术。Nicoya为预富集提供了优化的激活缓冲液与胺偶联试剂盒。不能被预富集的配体,需要通过其他方法固定,如通过组氨酸标签捕获偶联。
注意,缓冲液中胺组或强亲核试剂如Tris或叠氮化钠应避免与胺基耦联,因为这些基团将与配体竞争。
如果胺基耦联试剂盒不能达到足够的固定水平,可尝试增加的配体的浓度。如果它仍然不够,则需要进一步优化激活缓冲液。
3、COOH传感器芯片实验步骤:
注–本程序假设仪器中使用的是100µL的样品环。如果要安装更大的样品环,则需要重新调整体积。
1)按照标准程序,在OpenSPR仪器上安装羧基传感器芯片。
2)开始以最大流速运行缓冲液(ex.1X PBS pH 7.4)。
3)在达到信号基线后,从上样口注入80%的IPA,将控制阀转到inject,运行10s转回到load进行排气泡,达到基线后,缓冲液冲洗样本环,并用空气排空。
4)注入10mM的Hcl 清洗芯片表面,运行1min(芯片第一次用时需要此步骤)
5)减慢缓冲液流速至20µl/min。
6)解冻并立即混合1等分的EDC和NHS,注入到仪器中。与传感器相互作用5分钟。一旦相互作用结束,用缓冲液冲洗上样口并用空气排空。
7)用激活缓冲液稀释用于固定的配体, 体积为200µL浓度为10-50µg/mL。稀释后立即将配体注入仪器(相互作用5分钟 )。在EDC / NHS完成抽吸后,这步需要快速连续的进行。用缓冲液冲洗上样口并用空气排空。
单位换算:10ug/ml=10mg/L=[10mg/MW/mol)]/L=?mM/L = ?uM/L)
8)注入250µL封闭液(互相作用5分钟 )。一旦封闭液已经通过,传感器就可准备用于测量分析物和配体之间的结合相互作用。冲洗和清除样品回路。
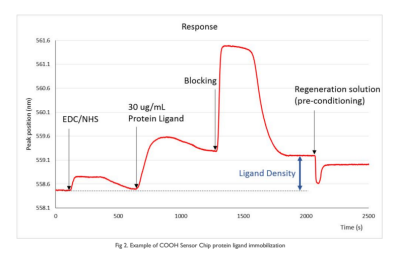
9)通过比较EDC/NHS活化前与闭锁后的信号,测量配体结合量。在图2所示的示例中,它是约700pm。
10)如有已知的再生缓冲液条件,将泵的速度提高到150ul/min,注入再生缓冲液初始化配体表面。
11)将泵速调到20ul/min,注入高浓度的分析物以确认配体的活性,并确认表面的近似的最大结合能力。清洗及排空样本环。
12)提高泵速到150µL/min,准备适当的再生缓冲液和装载250µL并注入以去除分析物。芯片表面即可用于分析物动力学分析。
如下图所示的例子。
图2 COOH传感器芯片配体的制备
更多资料请点击查看附件
