- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
Olink蛋白组学服务
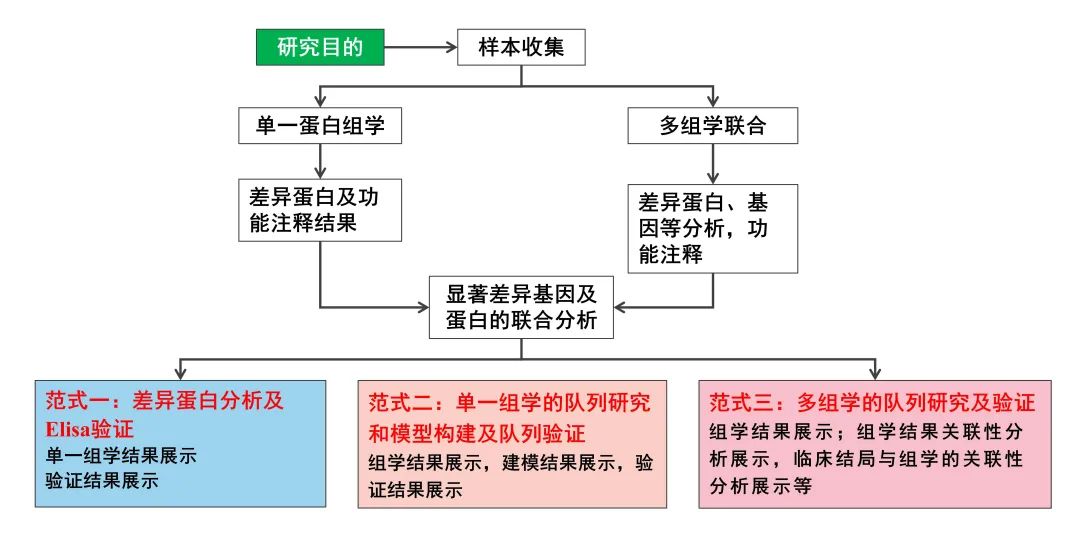
蛋白质作为生命活动的功能执行体,其研究的意义和价值不言而喻。目前对于蛋白质的研究技术也层出不穷,在项目研究初期,如何利用蛋白组学研究技术为科学研究及产业转化助力 ,离不开我们在课题设计时的深思熟虑,离不开我们对技术的如数家珍,更离不开既定的研究范式。今天给大家安利一些Olink蛋白组学研究的套路,如何通过该技术转化成研究论文,以及潜在的转化产品。
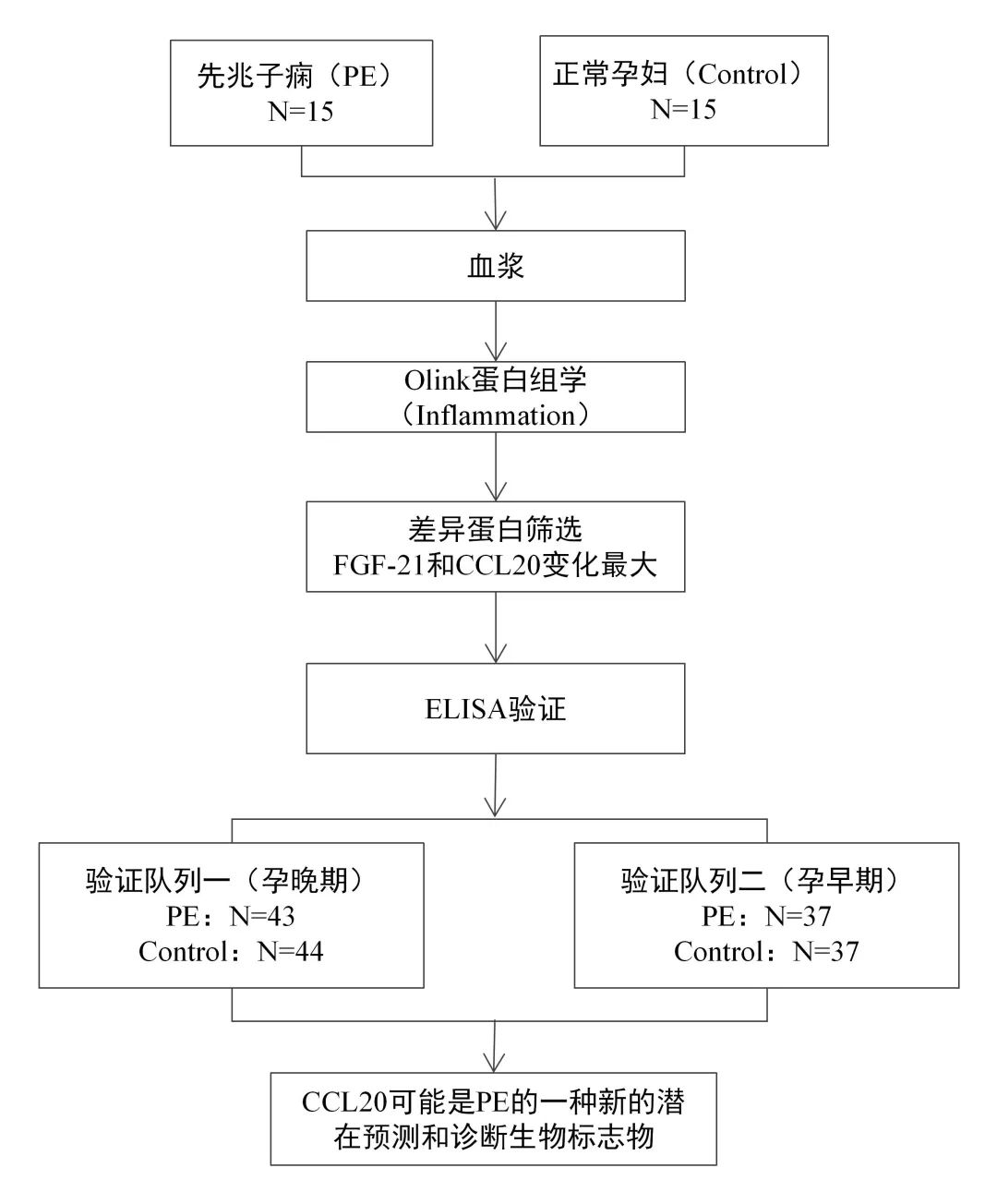
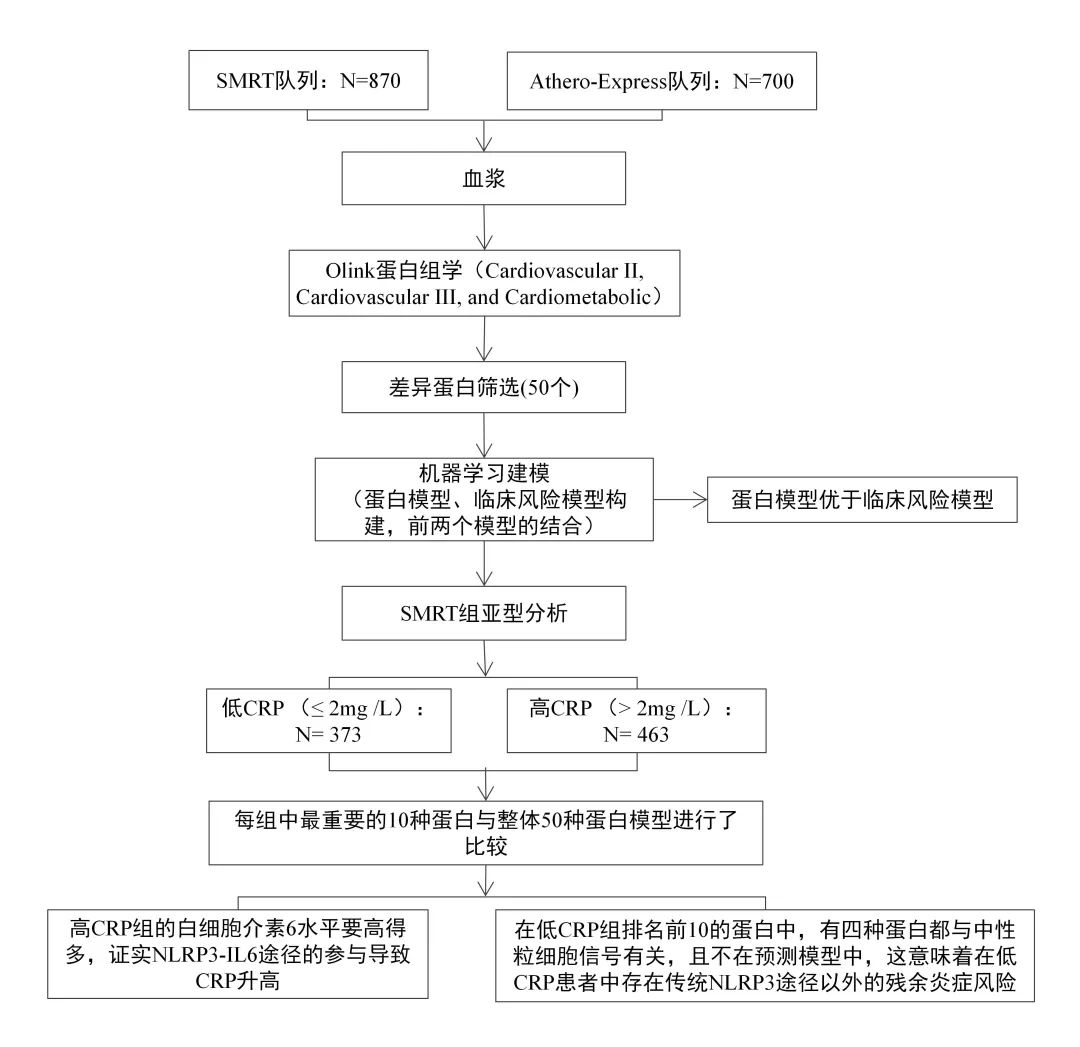
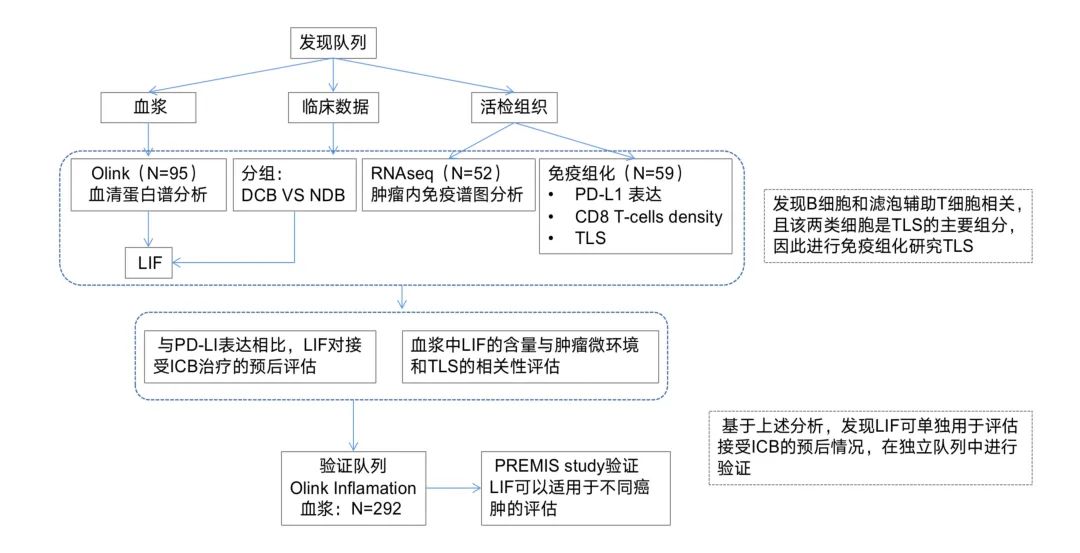
01 Olink发现+Elisa验证 (IF:5.370/Q1) 研究思路 研究概述 炎症通常被认为与先兆子痫(PE)的发生和发展有关,但其对PE的具体影响尚不清楚。在本研究中,使用基于高灵敏度和特异性邻近延伸测定技术的Olink炎症panel,测量了来自PE患者(n=15)和正常妊娠对照(n=15,n=15)的妊娠晚期母体血浆中92种炎症相关蛋白的表达水平。PE组和对照组共有28个炎症相关标志物存在差异。 其中,成纤维细胞生长因子21(FGF-21)和半胱氨酸-半胱氨酸基序趋化因子配体20(CCL20)的倍数变化最大。我们使用酶联免疫吸附试验(ELISA)进一步验证了妊娠晚期(43例PE和44例对照)和早期(37例PE和37例对照)孕妇血浆中CCL20的水平。据作者所知,这是他们首次发现CCL20在PE患者的妊娠晚期和妊娠早期血浆中上调,曲线下面积(AUC)分别为0.753和0.668。 总之,PE患者的大多数炎症标志物水平升高,CCL20可能是PE的一种新的潜在预测和诊断生物标志物。 02 Olink+队列研究(IF:35.855/Q1) 研究思路 研究概述 目前的风险评分并不能准确地识别出复发性动脉粥样硬化性心血管疾病(ASCVD)风险最高的患者,这些患者需要更强化的治疗干预,用机器学习技术分析高通量血浆蛋白质组学的进展,可能为进一步改善这些患者的风险分层提供新的机会。 在该项目研究中,运用Olink蛋白质组学技术对包含1,570例已确诊动脉疾病患者的两个队列进行研究,发现50个蛋白标志物在预测ASCVD事件复发方面优于临床风险模型。在发现和验证队列中,蛋白质组学模型在鉴别方面表现更好,并提供了比临床风险模型更显著的AUC。在低CRP患者中发现了中性粒细胞相关的途径,这意味着在传统的NLRP3途径之外还存在着残余的炎症风险。 03 Olink+RNAseq+免疫组化(IF:51.769/Q1) 研究思路 研究概述 免疫检查点阻断剂(ICBs)目前广泛应用于肿瘤学。然而,大多数患者并没有从这些药物中获益。因此,迫切需要确定新的、可靠的抗药性生物标志物,以便仅对具有预期治疗益处的患者开出潜在毒性和昂贵的治疗处方。作者分析了两个独立的前瞻性队列中接受ICB治疗的癌症患者(发现队列n=95,验证队列n=292)在治疗开始前收集的血浆样本的蛋白质组。然后,通过Cox比例风险模型研究了蛋白血浆水平、临床获益率、无进展生存率和总生存率之间的相关性。 研究表明,通过使用无偏的Olink蛋白质组学方法,在发现和验证队列中的白血病抑制因子(LIF)基线水平升高与接受ICB治疗的癌症患者的不良临床结局相关,与其他预后因素无关。作者还证明了LIF的循环水平与肿瘤微环境中三级淋巴结构的存在呈负相关。这一新的临床数据为LIF作为抗肿瘤免疫的潜在抑制因子的作用提供了强有力的证据,并表明以LIF或其途径为靶点可能是一种有希望的方法,可以结合ICB提高癌症免疫治疗的疗效。 04 小结


最后,关于Olink蛋白组学的研究范式,今天先汇总以下三个供大家参考,其他的研究范式,后续再给大家呈现。
参考文献 1.Wang X, Yip KC, He A, et al. Plasma Olink Proteomics Identifies CCL20 as a Novel Predictive and Diagnostic Inflammatory Marker for Preeclampsia. J Proteome Res. 2022;21(12):2998-3006. doi:10.1021/acs.jproteome.2c00544 2.Nurmohamed NS, Belo Pereira JP, Hoogeveen RM, et al. Targeted proteomics improves cardiovascular risk prediction in secondary prevention. Eur Heart J. 2022;43(16):1569-1577. doi:10.1093/eurheartj/ehac055 3.Loriot Y, Marabelle A, Guégan JP, et al. Plasma proteomics identifies leukemia inhibitory factor (LIF) as a novel predictive biomarker of immune-checkpoint blockade resistance. Ann Oncol. 2021;32(11):1381-1390. doi:10.1016/j.annonc.2021.08.1748