
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
Nat Commun丨臧充之团队等解析小鼠胚胎发育早期单细胞水平染色质表观遗传图
在哺乳动物胚胎发育中,原肠管 (primitive gut tube) 是许多重要器官的前体,包括肠、胃、胰腺、肝、肺、食道、咽部及甲状腺,因此原肠管的发育和分化始终是胚胎发育研究的重点。与将会发育为间充质细胞的中胚层细胞 (mesodermal cells) 不同,在原肠管内以单层细胞形式存在的内胚层细胞 (endodermal cells) 将在不同器官中形成功能性上皮细胞,例如肠中的吸收细胞,胃中分泌酸的壁细胞,以及胰腺中的外分泌细胞等。在小鼠胎龄9.5-13.5天 (E9.5–E13.5) 的器官形成 (organogenesis) 阶段,肠管逐渐开始出现具有形态特征的器官前体。这一过程由中胚层细胞主导,而内胚层在这个阶段仍然维持着单层细胞的形态。
近年的研究表明,看似相同的内胚层细胞沿前后轴呈现不同的基因表达模式,甚至在肠管发育的最早期就表达部分器官特异性的基因。然而,这种器官特异性的基因转录活动是如何被调控的仍不清楚。基于高通量测序的ATAC-seq技术用于在全基因组层面测定染色质的可及性,并且可以识别基因组内潜在的调控区域和转录因子结合位点。尽管近年来ATAC-seq已经被用于研究原肠管的发育调控,但研究对象主要聚焦于已有相对明确器官归属的E11.5-E16.5原肠管,且尚未达到单细胞水平。考虑到器官形成的过程早在E9.5就已开始,早期原肠管单细胞水平的表观遗传图谱亟待被描绘出来。
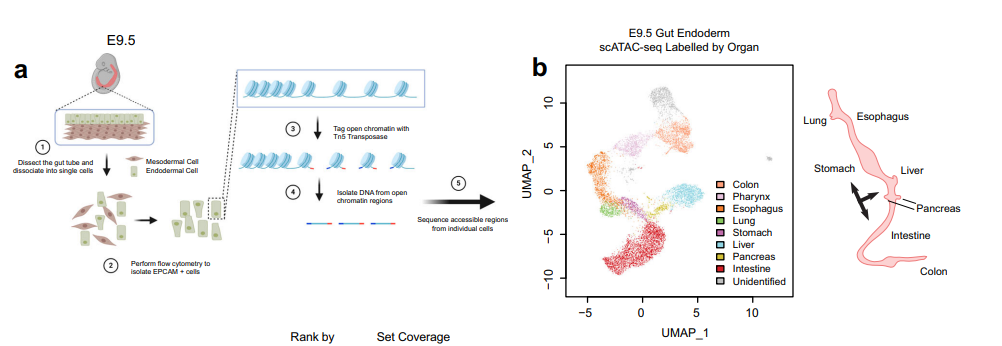
2022年5月26日,加拿大多伦多大学 (University of Toronto) Tae-Hee Kim教授和美国弗吉尼亚大学 (University of Virginia) 臧充之教授团队合作在Nature Communications上发表了题为Single-cell chromatin profiling of the primitive gut tube reveals regulatory dynamics underlying lineage fate decisions的研究论文,应用单细胞水平染色质转座酶可及性高通量测序技术 (scATAC-seq),首次发布了在单细胞水平描绘小鼠胚胎原肠管发育早期的染色质可及性表观基因组图谱,并结合不同发育阶段的表观组、转录组数据,描绘了整个肠管发育过程中表观基因组变化的综合图景。此外,作者还在小鼠模型上实验验证了关键转录因子异常表达对器官分化及细胞谱系命运决定 (lineage fate decision) 的影响。

作者通过对1.2万余个来自小鼠E9.5胚胎原肠管的单细胞scATAC-seq数据的分析,发现细胞类型特异的染色质开放区域富集在一些已知的器官分化标记基因附近,例如Sox2, Cdx2, Pdx1和 Nkx2-1等。结合基因本体 (gene ontology) 等分析,作者发现,在原肠管发育的早期,细胞的染色质状态便已预示了该细胞未来的命运。通过涵盖四个主要器官(肺、胃、胰腺、肠)数据的跨器官对比和时序分析,作者继续深入研究了不同器官的调控机制。作者的研究表明,肠管中的每个器官都采用一套独特的调控机制来推动其发育。在每个器官中,随着发育的进行,主导调控的转录因子也发生动态变化。

接下来,作者针对SOX2 和 CDX2这两个对肠管上皮细胞的成熟和分化至关重要的转录因子展开研究。通过比较Sox2或Cdx2基因敲除后染色质状态相较于对照组的变化,结合不同器官特有的染色质可及性模式,作者发现敲除关键转录因子会直接转变细胞谱系的命运决定。例如,敲除Sox2基因后,胃上皮细胞的染色质表观组状态将向邻近器官(如肺)的染色质状态转变;而敲除Cdx2基因会使得肠上皮细胞的染色质状态向前肠 (foregut) 的染色质状态转变。
作者进一步运用免疫荧光技术,在小鼠模型上验证了Sox2异常表达对胰腺和肠上皮细胞命运决定以及器官形成的严重干扰,并发现Sox2在胰腺中的异常高表达会引发成年小鼠胰腺出现与癌症相似的形态变化。
这些发现填补了过去研究者对胚胎发育早期的原肠管内胚层细胞染色质状态认识的空白,全面描绘了在肠管发育过程中染色质状态与转录因子对基因表达调控的协同参与,对理解胰腺癌等肿瘤的发生和发展具有启发性的作用。
