
- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
CD274自噬降解的机制的阐明
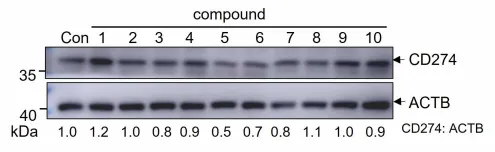
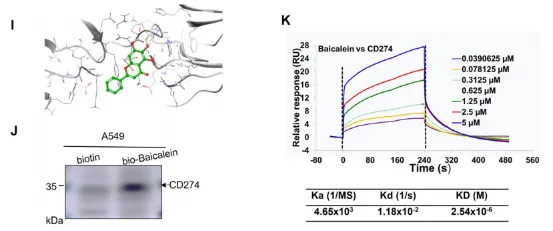
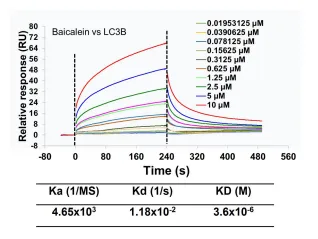
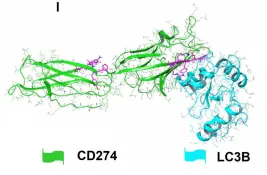
在当今临床治疗领域,免疫检查点抑制剂发挥着至关重要的作用,尤其是针对CD274/PD-L1的药物,展现出了强大的疗效。然而,现有的抗体类药物存在诸多局限性,如口服生物利用度较低,难以通过口服有效吸收;膜穿透性较差,在体内的运输和分布受限;响应率也不尽人意,无法满足临床治疗的更高需求。 2024年12月22日,同济大学的范理宏老师以独立通讯作者的身份,在《Autophagy》(影响因子IF=14.6)上在线发表了题为“Baicalein tethers CD274/PD-L1 for autophagic degradation to boost antitumor immunity”的研究论文。该研究取得了突破性进展,发现了黄芩素(baicalein)能够靶向CD274,并诱导其通过巨自噬/自噬途径发生降解。 在研究过程中,作者借助薛定谔软件,运用虚拟筛选和分子对接技术,从2694种传统中药单体中精心筛选出了10种潜在的CD274抑制剂。针对这10种化合物,作者开展了免疫印记实验。实验结果如上图所示,清晰地展示了10种化合物对A549细胞中CD274蛋白水平的影响,其中黄芩素(化合物5)表现尤为突出,显著降低了A549细胞中CD274的丰度。 为了深入探究黄芩素对CD274的靶向性机制,作者设计并进行了分子对接、Western blot、SPR等一系列实验。从图1可以看到:在(I)分子对接模型中,黄芩素与CD274相互作用界面以卡通形式清晰呈现;(J)利用生物素进行体外亲和分离实验的代表性结果表明,将A549细胞的裂解物与生物素或生物素 - 黄芩素在4℃下孵育过夜后,裂解物用于链霉亲和素 - 琼脂糖亲和分离测定,并通过免疫印迹法对沉淀物进行CD274解析;(K)表面等离子体共振(SPR)对黄芩素与CD274结合的分析则是将重组人CD274蛋白固定在活化的CM 7传感器芯片上,然后使一系列浓度的黄芩素流过芯片。 分子对接结果(图I)显示,黄芩素通过氢键等非共价键作用巧妙地嵌入到CD274的晶体结构中,从而形成了稳定的复合物。免疫印迹(图1J)有力地证明了CD274与黄芩素能够稳定结合。利用Biocore平台进行的表面等离子体共振(SPR)测定,进一步证实了黄芩素和CD274之间的相互作用。通过测定,黄芩素与CD274蛋白结合的平衡解离常数(KD)约为2.54 μM(图1K)。基于这些实验结果,可以充分证明黄芩素能够与CD274相互作用,进而降低CD274稳态蛋白的丰度。后续的体内外实验也进一步佐证了这一点,证实黄芩素是肺癌的潜在CD274抑制剂。 作者并未止步于此,而是进一步通过TILs、流式细胞术、IHC、免疫共沉淀、双分子荧光互补(BiFC)等实验,发现CD274可以直接与LC3B结合,形成稳定复合物。在MST实验中,两者的解离常数约为108nM,这一数据足以证明CD274与LC3B结合的稳定性。在此基础上,作者还进行了蛋白 - 蛋白对接,深入分析其内在机理。 为了更深入地了解黄芩素促进CD274降解的具体机制,作者构建了CD274突变体进行研究。研究发现,黄芩素能够增强CD274与LC3的相互作用,进而促进CD274的自噬降解,最终有效地恢复T细胞介导的抗肿瘤免疫,抑制肿瘤生长。由此可见,黄芩素就像一种分子“胶水”,被确认为是具有显著肿瘤治疗潜力的小分子CD274抑制剂。 综上所述,本研究成功筛选出黄芩素这一新型的CD274抑制剂,并通过一系列严谨的实验,全面、深入地阐明了其促进CD274自噬降解的机制。展望未来,相关研究将围绕黄芩素在肿瘤免疫治疗中的临床应用潜力展开进一步探索,同时致力于优化其药代动力学特性,期望能够实现更为理想的治疗效果,为肿瘤治疗领域带来新的曙光。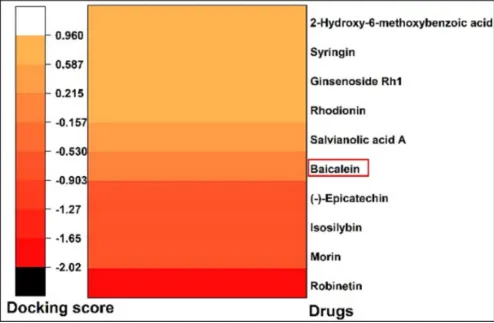
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务
