基于活性的蛋白质组学分析(activity-based protein profiling,ABPP)是由Scripps研究所Cravatt教授团队开发,旨在利用不同反应活性的化学探针研究蛋白质的活性与功能。经过不断的迭代发展,该技术已经被广泛应用于共价小分子药物靶点发现和先导化合物筛选领域。
以靶向半胱氨酸残基的共价小分子为例,其技术路线即是利用靶向半胱氨酸的特异性化学探针为通用型探针,当共价小分子优先占据靶点蛋白质的活性半胱氨酸残基时,则会与通用型探针产生竞争,减弱探针的标记强度,结合定量蛋白质组学技术,能够高效准确地鉴定共价小分子修饰蛋白质以及位点。2016年Cravatt教授团队利用上述策略筛选共价小分子先导化合物,靶向“无药可及”的蛋白质靶点[5]。该团队首先构建了一个靶向半胱氨酸残基的共价分子片段库,它们具备与很多共价靶向药物相同的丙烯酰胺或氯乙酰胺活性反应基团,结合化学蛋白质组学技术,作者全面探究了人类蛋白质组中半胱氨酸残基与小分子片段的结合能力,在637个不同蛋白质上鉴定出758个能够与小分子片段共价连接的活性半胱氨酸残基,其中大部分都没有在DrugBank数据库中发现,极大地完善了人类蛋白质组与结构各异的共价小分子相互作用数据网络。该方法的运用加速了共价药物先导化合物的筛选,在复杂蛋白质组水平上大规模发掘潜在配体结合口袋,为靶向“不可成药”蛋白质提供了机会。该竞争性化学蛋白质组学技术还被应用于内源代谢产物小分子如hydroxynonenal(HNE)[6]、天然产物如具有抑癌活性的萜类化合物nimbolide的靶点发现中。
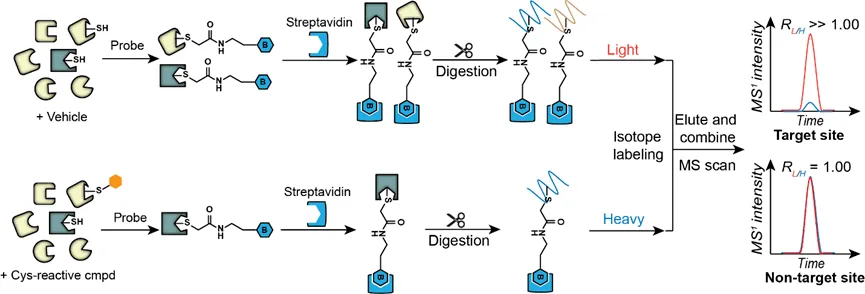
竞争性定量化学蛋白质组学技术鉴定共价药物分子靶点和修饰位点技术路线示意图近年来,靶向蛋白降解(targeted protein degradation, TPD),即利用药物分子干预蛋白质的表达从而实现疾病治疗的策略层出不穷,最受关注的要属PROTAC(proteolysis targeting chimeras)药物。PROTAC概念最早由Crews等人在2001年提出,该策略的核心思想是利用细胞内自有的泛素-蛋白酶体系统降低靶标蛋白的丰度,从而达到疾病治疗的目的。同时,PROTAC药物因其活性高、能够靶向“不可成药”靶点、克服药物耐药性等优势成为各大药企的重点研发产品,辉瑞、拜耳、默沙东等国际制药巨头都在该方向上有所布局。类似的,同样利用泛素-蛋白酶体系统的分子胶降解技术(molecular glue degraders)、利用内吞-溶酶体途径的LYTAC技术(lysosome targeting chimeras)、利用自噬-溶酶体途径的AUTAC(autophagy targeting chimera)和ATTEC(autophagosome tethering compounds)技术等。然而,这类分子研发过程中关键评价之一是能否特异性降解靶标蛋白,而不会导致细胞内其它蛋白质的丰度改变。定量蛋白质组学技术,即在蛋白质组水平,利用高分辨质谱定量比较不同样品中相同蛋白质的含量,在该类药物分子研发过程中扮演着不可或缺的角色,目前比较常用的定量蛋白组学策略是在肽段样品制备过程中引入稳定同位素标签。质谱检测时,来自不同样品,同一氨基酸序列的肽段物理性质类似,具有相同的保留时间,电荷数,离子化效率和碎裂模式,但由于同位素标签质量不同,从而表现出不同的荷质比,共流出的同一序列肽段离子强度之比即能够定量反映不同样品中同一蛋白质的含量。该策略不仅提高了了样品制备、质谱数据采集等过程的效率,同时减少了样品与样品之间的实验误差,使结果更加稳定、可信。
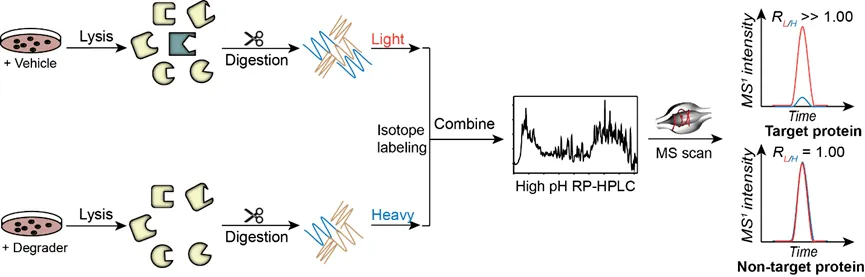
定量化学蛋白质组学技术鉴定PROTAC分子降解靶点技术路线示意图随着各学科的发展和交融,尤其是近年来化学生物学交叉学科的出现,将药物开发带入了高速发展的新纪元,有望极大缩短新药发现的周期。化学蛋白质组学技术的不断发展,促进了细胞内代谢物、天然产物、合成药物等小分子的靶点研究和全新药物先导化合物的发现,为小分子新药研发注入了新的活力,使得原来被认为“不可成药”的蛋白质有了成为新的治疗靶点的可能。





