化学蛋白质组学技术旨在利用一系列功能各异的化学探针,结合蛋白质组学,解决复杂体系(细胞裂解液,活细胞,组织等)中小分子如何与蛋白质相互作用的问题,已被成功用于小分子靶点发现、创新药物先导化合物筛选等研究中。
在细胞裂解液甚至活细胞中针对成千上万个蛋白质靶点同时分析它们的药物可及性,一方面能够快速得到全新结构的先导化合物,并了解它们的靶点选择性,另一方面能够积累大量的小分子与蛋白质直接相互作用关系,为人工智能驱动的药物设计策略提供更真实、更有价值的数据库。生物体中小分子与蛋白质之间的相互作用关系(例如靶点占据率,选择性等)是药物结构改良和成药的关键信息。目前,化学蛋白质组学技术在药物靶点发现中得到了广泛的应用,解析了包括天然产物、代谢物、合成药物和多肽等多种药物形式的作用机制。一般来说,该技术包括具有生物活性的分子探针设计与合成,复杂蛋白质组中探针原位标记结合蛋白质,标记蛋白与背景蛋白质分离,肽段样品制备,质谱检测以及数据分析等步骤,其中,根据已知分子信息(结构,SAR,表型等),设计合成相对应的分子探针是该过程的核心环节之一,即在合适的位点对小分子进行化学修饰(生物正交化,光交联化等),该类探针不仅保留了与潜在靶标蛋白结合的能力,同时能够实现后续结合蛋白质的分离富集,从而鉴定到目标蛋白。早在20世纪90年代,哈佛大学Schreiber教授团队就将天然免疫抑制剂 FK506结合在固相载体上,找到其结合蛋白FKBPs,推测该系列蛋白参与调控T细胞激活和相关代谢过程。后来,科学家们又在小分子上连接上biotin作为后续富集的工具,使得活细胞中小分子探针与蛋白质孵育结合成为可能,更加接近生理条件下小分子与其靶点蛋白之间的反应,该方法目前仍被使用。然而,以上方法存在明显的缺陷,比如biotin的结构和分子量都较大,直接修饰到小分子上,可能会引起小分子探针的化学性质和生物活性发生显著改变,导致其结合蛋白谱与原始小分子差异太大,而出现假阳性信号。随着化学生物学的发展,生物正交反应如铜催化炔基-叠氮之间的点击化学反应(CuAAC)在化学蛋白质组学中大放异彩,使得小分子的功能化修饰变得更加简单有效,例如炔基化或者叠氮化,由于修饰基团结构非常小,基本不影响小分子原本的活性。除此以外,很多生物体内源性活性分子、小分子药物和天然产物与其靶标蛋白的结合是非共价的,在靶点发现过程中通常需要对蛋白质变性处理以及使用强去垢剂以降低非特异性吸附背景,因此这类非共价结合就容易丢失,从而造成靶标蛋白鉴定失败,因此将这类非共价结合转化成稳定的共价结合对于靶点发现效率的提高十分重要。光交联亲和技术(photoaffinity labeling, PAL)是近年来较为常用的转化方法。在小分子上连接上如双吖丙啶等光交联基团衍生出小分子探针,当探针与活细胞孵育一定时间后,在紫外光的照射下,光反应基团产生自由基中间体,与邻近蛋白质迅速发生插入反应,将小分子与蛋白质之间的非共价结合转化为共价结合。2013年,来自新加坡国立大学的Yao教授团队将光交联基团和炔基结合在一起,构建了结构极简的双功能分子,使得小分子的改造简洁化且不会影响小分子本身的活性。利用这种方法,多种天然产物,比如黄芩苷,脂类代谢物分子等,都发现了相应的靶标蛋白,为揭示该类分子的生物学功能和后续优化成药提供了非常有价值的信息。
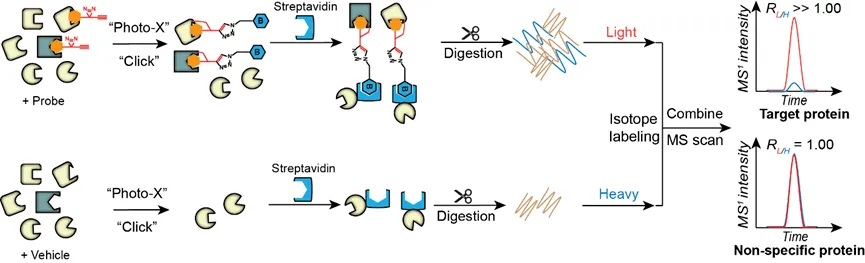
定量化学蛋白质组学技术鉴定非共价药物分子靶点技术路线示意图
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务