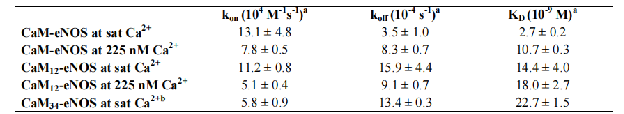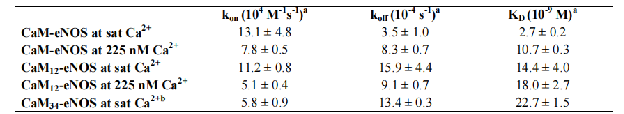酸性小分子蛋白-钙调蛋白(CaM)是钙离子感受器和许多酶的控制元件,包括一氧化氮合酶(NOS),这些酶在关键的生理和病理过程中发挥重要作用。CaM结合引起NOS的构象变化,从而允许还原酶和氧合酶域之间的电子转移,这一过程被认为是高度动态的。NOS酶中的电子流发生于NADPH,通过FAD和FMN辅因子到血红素氧合酶域。最近利用脉冲电子-电子双共振(PELDOR)光谱、单分子荧光共振能量转移(FRET)光谱和电子冷冻显微镜(EM)的研究,更好地了解了CaM激活NOS的机制。这些研究表明NOS酶包含一个二聚氧酶结构域,该结构域作为整个酶分子的锚定二聚体结构。两侧有两个分离的还原酶结构域,存在于FAD-FMN电子转移(输入状态)和FMN -血红素电子转移(输出状态)之间的构象平衡中,与CaM结合诱导构象平衡的改变,从而允许NOS酶中的有效电子转移。
当CaM与NOS完全结合时,CaM的氨基端小叶残基与NOS的FMN子结构域相互作用并形成桥接相互作用,这似乎是控制FMN与血红素相互作用所必需的。CaM通过稳定和精确定位FMN子域,使电子从FMN穿梭到氧合酶域,从而激活NOS。 2016年10月4日,Michael Piazza 在Biochemistry发表了《Structural Studies of a Complex Between Endothelial Nitric Oxide Synthase and Calmodulin at Physiological Calcium Concentration》, 这篇报道使用核磁共振波谱来确定内皮型一氧化氮合酶(eNOS)肽与CaM在最低Ca2+浓度(225 nM)下的复合物的溶液结构,这是CaM与eNOS结合所需的最低Ca2+浓度,对应于哺乳动物细胞中发现的生理上升高的Ca2+水平。在这些条件下,CaM-eNOS复合物有一个与eNOS肽结合的钙离子丰富的羧基端小叶和一个与eNOS肽松散结合的钙离子游离的氨基端小叶。随着Ca2+浓度的增加,CaM 氨基端小叶与Ca2+的结合导致与eNOS肽羧基端区域的相互作用增强,并增加了肽的α-螺旋结构,这可能是导致电子从FMN转移到酶加氧酶域的血红素的机制的一部分。在相同条件下进行的SPR研究表明,Ca2+浓度依赖性结合动力学与NMR结构结果一致。表面等离子共振显示Ca2+浓度的增加稳定CaM-eNOS复合物。采用SPR进一步分析eNOS肽与CaM在225 nM Ca2+上的相互作用。SPR分析使我们能够使用非标记系统来确定蛋白质与肽的结合动力学。这种结合相互作用的动力学,包括结合亲和力,结合和解离率,通过在固定的eNOS肽表面注射不同浓度的CaM来确定。在0.1 mM的饱和Ca2+浓度下获得不同CaM浓度(10到500 nM)的传感器图,以确保Ca2+充足的CaM与eNOS肽的最佳相互作用。
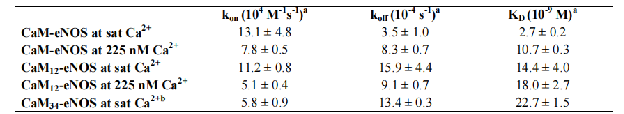
表:在225 nM Ca2+和sat Ca2+条件下,eNOS靶肽与CaM的 kon速率常数和koff速率常数
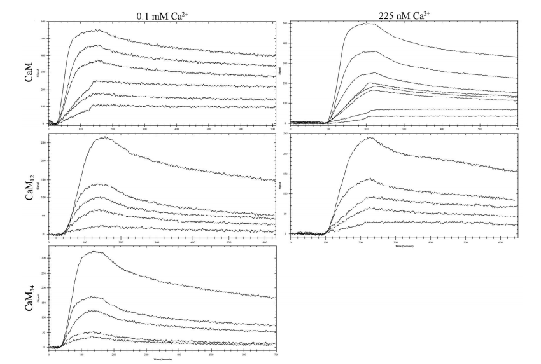
图:各种CaM构建体和eNOS肽在饱和Ca2+ (0.1 mM CaCl2)和225 nM游离Ca2+时的KD和koff比较
武汉研锦生物面向制药企业、医院和科研院所,可提供药物钓靶质谱鉴定分析和检测分子间亲和力服务。包括药物高通量虚拟筛选、分子对接分析、 动力学模拟、细胞原位垂钓靶点蛋白等,以及SPR、MST、DSF、BLI、ITC等亲和力检测服务和Olink 高灵敏超微量多指标蛋白芯片检测服务。涉及小分子药、生物药、中药、天然药物等多种新药类型,为您提供优质的药物钓靶和活性检测服务。