- 所有服务
- 生命科学服务平台
- 诊断原料开发服务平台
- 抗体药物研发服务平台
动力学分析之两分子结合和解离的速率快慢?
- 产品信息(Product Details)
动力学在分子互作中是用来描述分析物与配体之间结合的速率(ka)和解离的速率(kd),是表征分子结合很重要的参数。在药物研发过程中,我们可以通过检测结合或者解离速率来判断结合的药物分子作用的时间和效果。
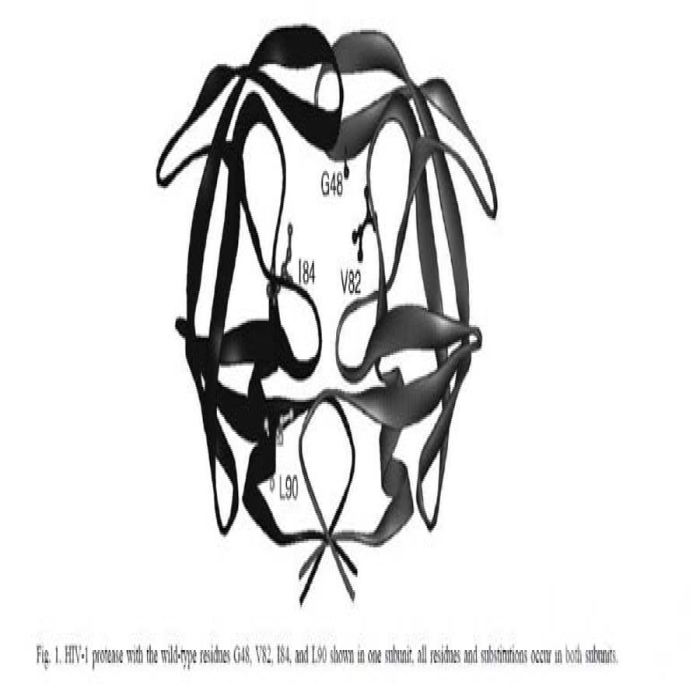
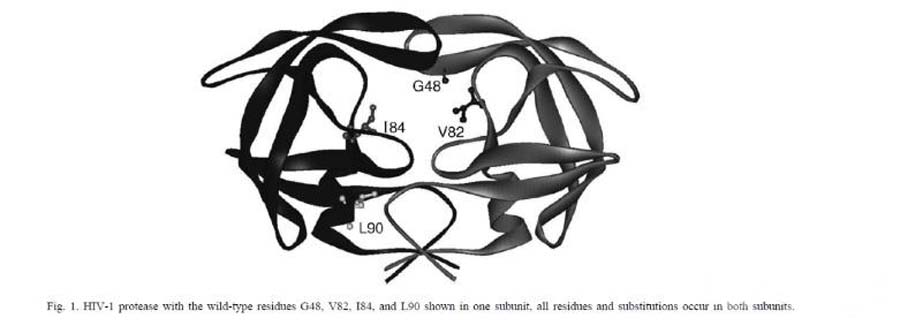
为了研究抑制剂的结构和耐药性之间的关系,做了关于HIV-1蛋白酶耐药突变体和一系列抑制剂之间的研究。突变体是根据已知的临床常用抑制剂耐药突变体,并结合蛋白酶中的氨基酸的位置进行设计。如下图所示,作者构建了单个和多个位点的突变,突变的氨基酸伟G48V,V82A,I84V和L90M。
接下来,通过Biacore检测野生型/突变的HIV蛋白酶和抑制剂之间的亲和力和动力学参数。结果如下方的表格所示。
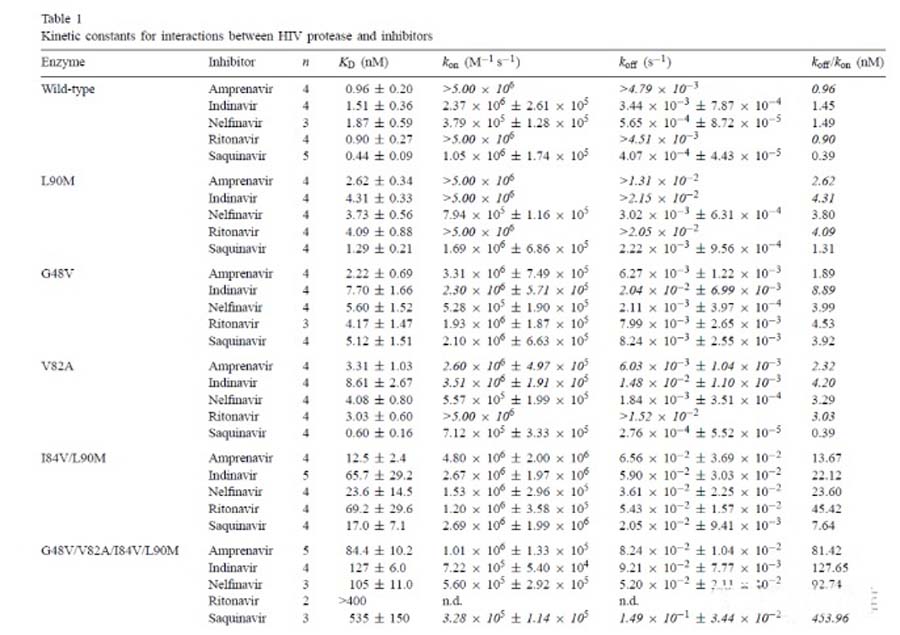
通过进一步对结合动力学进行分析,发现和野生型相比,突变体和抑制剂之间的解离速率明显增加。
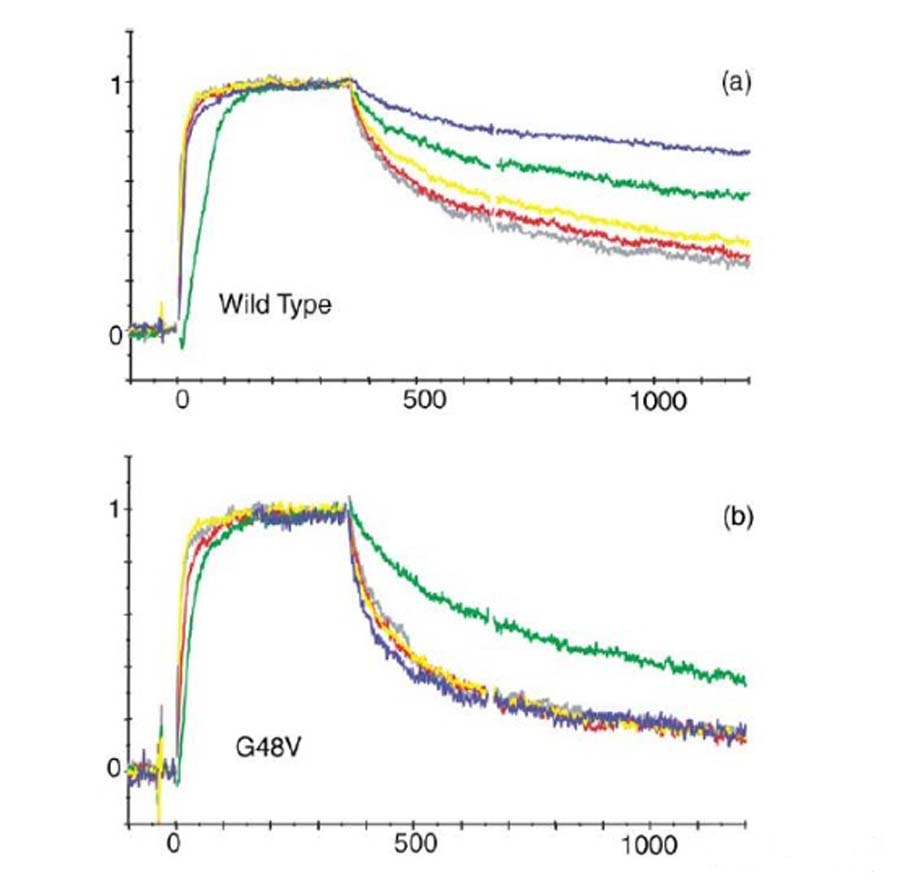
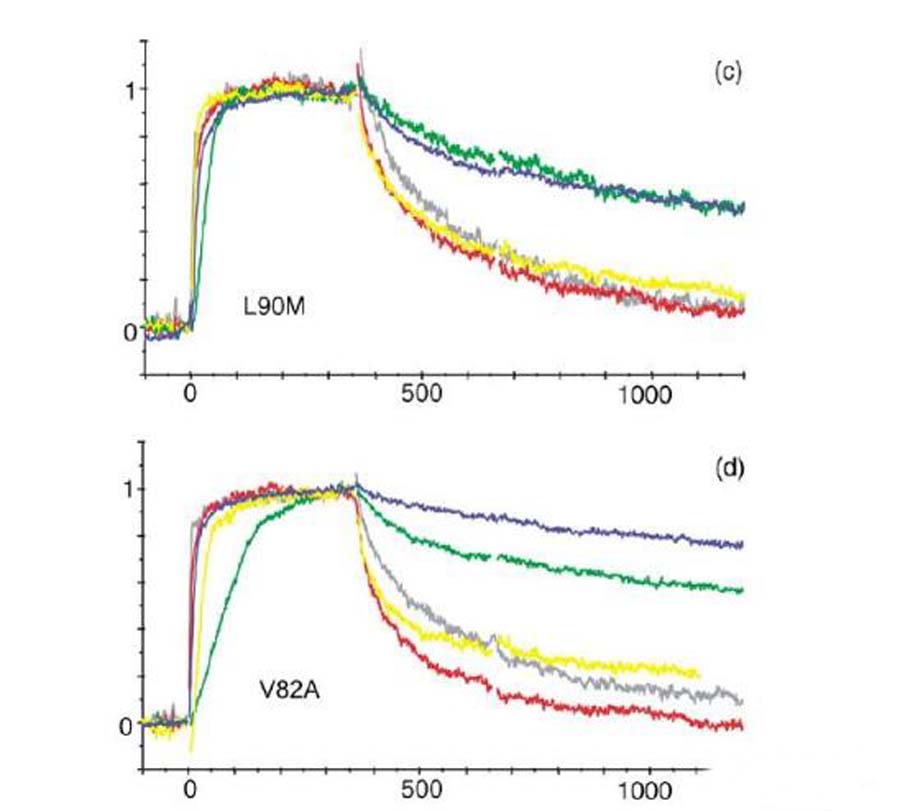
Fig.2. 野生型/突变体和抑制剂之间结合动力学分析
进一步对实验结果进行了讨论和分析。Leu90是一个位于二聚体表面的氨基酸残基,替换为Met降低了二聚体的稳定性。本次实验表明,Leu90替换为Met,对抑制剂的结合具有非特异性的作用,由于解离速率增加而亲和力减弱。
Gly48位于蛋白酶的flap区,对于结合位点成型和酶复合体稳定性具有重要的作用,这个位点突变之后,对saquinavir形成耐受性,解离速率增加。而82和84位点位于活性位点,突变之后引起亲水性和范德华力作用的减少,数据表明结合和解离速率的改变引起亲和力的减弱。
研锦生物可以利用基于靶点或小分子结构的药物设计方法,对可购买化合物、天然产物等数据库进行虚拟筛选,并获得潜在活性的化合物列表供进一步活性实验确证。 面向制药企业和科研院所,可提供一站式的早期药物研发服务,包括虚拟药物筛选、先导优化、靶标预测、 动力学模拟等,涉及小分子化学药、生物药、中药等多种新药类型,为您提供优质的药物发现服务。